



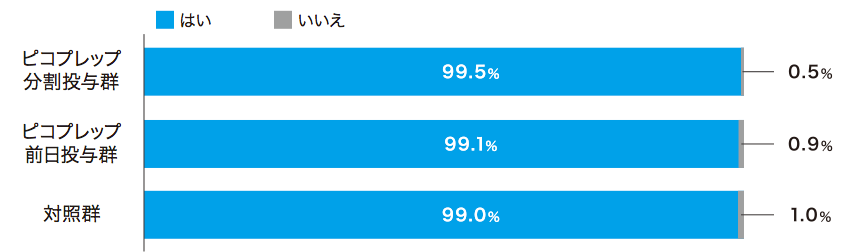
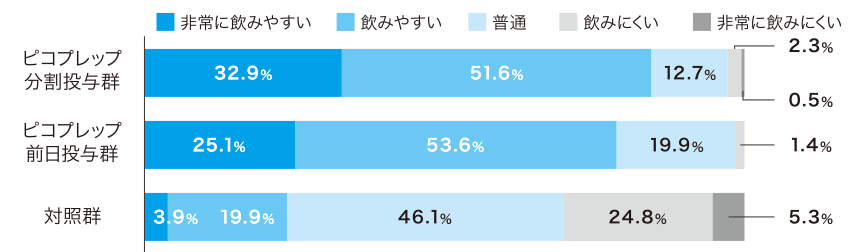
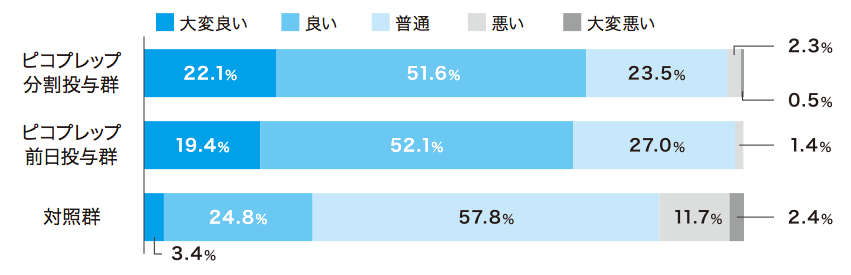
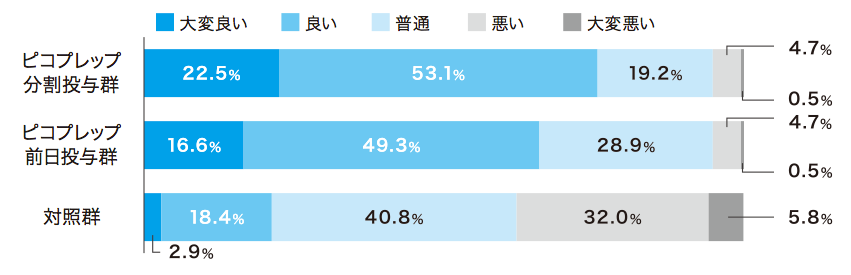
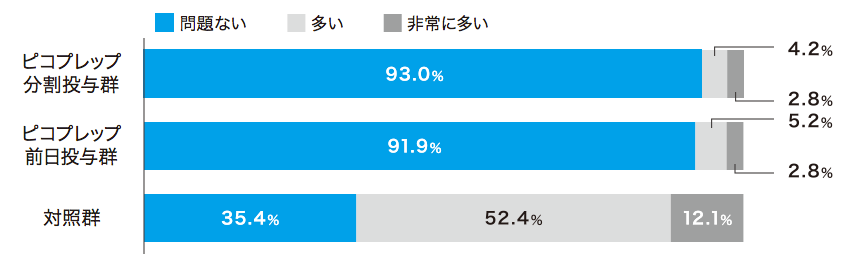
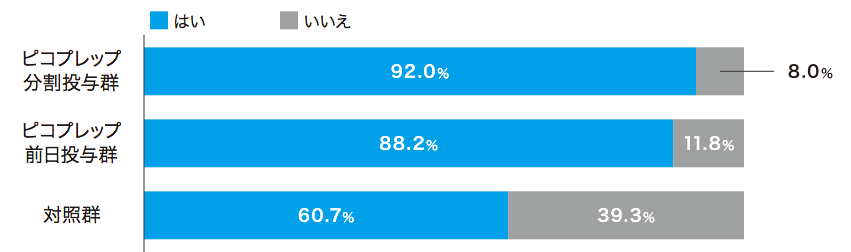
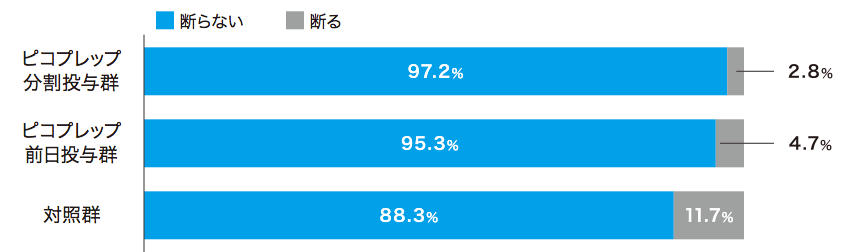
患者質問票において、ピコプレップ両群で約80%が「非常に飲みやすい」「飲みやすい」(Q2)と回答しました。味(Q4)および量(Q5)については、Q4の前日投与群を除いて70%以上が「大変良い」「良い」あるいは「問題ない」と回答し、約90%が次回の処方(Q6)を希望しました。
各質問の回答者数:ピコプレップ分割投与群 n=213、ピコプレップ前日投与群 n=211、対照群 n=206
| 【目的】 | ピコプレップ分割投与及び前日投与におけるナトリウム・カリウム配合内用剤に対する非劣性を検証する。 |
|---|---|
| 【対象】 | 大腸内視鏡検査が必要とされる20~80歳の日本人男女637例(男性340例、女性297例、平均年齢48.2歳) |
| 【方法】 | 第Ⅲ相多施設共同無作為化評価者盲検非劣性試験。対象をピコプレップ分割投与群(n=214)、ピコプレップ前日投与群(n=212)及び対照群(n=211)に無作為に割り付け、次のように投与した。 [ピコプレップ分割投与群]1回1包を150mLの水に溶解し、大腸内視鏡検査前日の夜(17~21時)及び検査当日の朝の2回服用した。1回目の服用後は1回250mLの透明な飲料を最低5回、2回目の服用後には1回250mLの透明な飲料を最低3回飲用した。 [ピコプレップ前日投与群]1回1包を150mLの水に溶解し、大腸内視鏡検査前日の夕(16~18時)及び1回目投与から6時間後(22~24時)の2回服用した。1回目の服用後は1回250mLの透明な飲料を最低5回、2回目の服用後には1回250mLの透明な飲料を最低3回飲用した。 [対照群]大腸内視鏡検査当日にナトリウム・カリウム配合内用剤1袋を水に溶解して約2Lとし、検査開始予定時刻の約4時間前から服用を開始した。溶解液2~4Lを1時間あたり約1Lの速度で服用した。排泄液が透明になった時点で服用を終了し、4Lを超える服用は行わなかった。 |
| 【主要評価項目】 | 独立中央判定委員会による腸管洗浄度評価スケールに基づく全般的腸管洗浄度の有効率* |
| 【副次評価項目】 | 治験担当医師による腸管洗浄度評価スケールに基づく全般的腸管洗浄度の有効率*、治験担当医師によるOttawaスケールを用いた腸管洗浄度の合計スコア、被験者質問票を用いた薬剤の受容性評価 |
| 【解析計画】 | 有効率の非劣性検定については、ピコプレップ各投与群と対照群との有効率の差及びMatsuda and
Sano methodに基づくその95%信頼区間を算出し、非劣性限界値を-0.1(-10%)とし閉手順(固定順検定)で評価した。対照群とピコプレップ分割投与群の比較において非劣性が検証された場合にのみ、対照群とピコプレップ前日投与群の非劣性検定を行った。ピコプレップ各投与群と対照群の非劣性が確認された場合に、ピコプレップの各投与群が対照群に対して優位であるかを検討し、有効率の差の両側95%信頼区間の下限値が0を超えた場合には、ピコプレップの各投与群が対照群に対して優位であるとした。独立中央判定委員会が判定した有効率と治験担当医師が判定した有効率の一致割合について、各投与群と全体でCohen のκ係数を算出し、一致度の検討を行った。全般的腸管洗浄におけるOttawa スケールの合計スコアは、投与群を固定効果、実施医療機関を変数とした共分散分析(ANCOVA)モデル解析を用いて解析した。患者質問票を用いた薬剤の受容性評価は、共分散分析(ANCOVA)モデル又はロジスティック回帰モデルを用いて解析した。
*腸管洗浄度評価スケール(1:腸管内に残便がほとんど見られず、良好な観察が可能、2:残便が存在するが観察に支障をきたさない、3:残便の存在が観察に支障をきたす、4:残便が多く観察が不可能、5:判定不能)によるすべての大腸部位の評価が1又は2であった患者(「有効症例」と定義)の割合 |
| 【安全性】 | 投与群別の副作用発現率は、ピコプレップ分割投与群では 8.9%(19/213 例)、ピコプレップ前日投与群では9.5%(20/211 例)、対照群では 11.1%(23/208 例)であった。ピコプレップ投与群の主な副作用は、血中マグネシウム増加〔ピコプレップ分割投与群 0.9%(2/213 例)、ピコプレップ前日投与群 2.8%(6/211 例)〕、悪心〔1.4%(3/213 例)、0.9%(2/211 例)〕、直腸炎〔1.4%(3/213例)、0.9%(2/211 例)〕であった。副作用として死亡例、重篤例及び投与中止例は認められなかった。 対照群の主な副作用は、悪心 1.9%(4/208 例)、血中ビリルビン増加 1.4%(3/208 例)、血中リン減少 1.4%(3/208 例)、尿中血陽性 1.4%(3/208 例)であった。副作用として死亡例及び重篤例は認められなかったが、投与中止に至った副作用は嘔吐が 1 例報告された。 |
社内資料:国内第Ⅲ相試験(J-CLEAR)[承認時評価資料][フェリング・ファーマ依頼実施治験]

本Webサイト「ピコプレップ.jp」は、
医療用医薬品を適正に御使用いただくため、
医療関係者の方を対象に情報を提供しています。